考研真题
1. 沈阳师范大学化学与生命科学学院《630分析化学》历年考研真题汇总
2. 全国名校分析化学考研真题汇总(含部分答案)
考研指导书
1. 武汉大学《分析化学》(第6版)(上册)笔记和考研真题
2. 武汉大学《分析化学》(第6版)(上册)配套题库【考研真题精选+章节题库】
3. 武汉大学《分析化学》(第6版)(下册)笔记和考研真题
4. 武汉大学《分析化学》(第6版)(下册)配套题库【考研真题精选+章节题库】

沈阳师范大学化学与生命科学学院《630分析化学》历年考研真题汇总
书籍目录
第一部分 沈阳师范大学630分析化学考研真题
2014年沈阳师范大学625分析化学考研真题
2013年沈阳师范大学624分析化学考研真题
2012年沈阳师范大学624分析化学考研真题
第二部分 兄弟院校分析化学考研真题
2014年河南师范大学622分析化学(B卷)考研真题
2013年河南师范大学622分析化学(B卷)考研真题
2012年河南师范大学622分析化学(B卷)考研真题
2011年河南师范大学612分析化学(A卷)考研真题
2010年河南师范大学606分析化学(A卷)考研真题
2009年河南师范大学606分析化学(B卷)考研真题
2008年上海师范大学464分析化学考研真题
2007年上海师范大学464分析化学考研真题

部分内容
第一部分 沈阳师范大学630分析化学考研真题
2014年沈阳师范大学625分析化学考研真题
2014年招收攻读硕士学位研究生入学考试试卷
科目代码:625
科目名称:分析化学
适用专业名称:分析化学
考生注意:请将答案写在答题纸上,写在本题签及草纸上无效。考试后本题签同答题纸一并交回。
可能会用到的原子量信息:
H – 1; N – 14;O – 16;S – 32;Cl – 35.5;K – 39;Ca – 40;I – 127;Ba – 137
一、填空题(共7空,每空2分,合计14分)
1银量法中佛尔哈德法使用的指示剂是___①___;法扬斯法的指示剂是__②____。
2盐效应会使沉淀的溶解度__③____。
3由Fe3O4的重量计算Fe含量时的换算因数为___④___;由BaSO4的重量计算(NH4)2Fe(SO4)2•6H2O含量时的换算因数为___⑤___
4酸性条件下,使用高锰酸钾滴定过氧化氢,反应的离子方程式为:___⑥___
5.标定KMnO4时,为了加快反应速度,可以加入__⑦___
二、简答题(共5题,每题2分,合计10分)
请使用一种溶液区分下面两种物质,并简述实验现象。
(1)KAc和K2S
(2)BaCrO4与PbCrO4
(3)Bi2S3与Sb2S3
(4)CuS与HgS
(5)PbSO4与BaSO4
三、判断题(共4题,每题3分,合计12分)
判断下列酸性未知溶液的定性分析报告是否合理,并说明主要理由。
(1)Cr2O72−、Ca2+、NO3−、I−
(2)Hg2+、Cl−、NO3−、Cu2+
(3)Na+、S2−、S2O32−、K+
(4)Fe3+、Ni3+、I−、Cl−
四、计算题(共8题,合计114分)
1用50.00 mL某KMnO4标准溶液恰能氧化一定的KHC2O4·H2O,同样质量的KHC2O4·H2O又恰能与15.20 mL浓度为0.20 mol/L的KOH溶液反应。计算此KMnO4溶液的浓度。(10分)
2在0.5 mol/L H2SO4介质中,等体积的0.80 mol/L Fe2+溶液与0.40 mol/L Ce4+溶液混合。反应达到平衡后,Cr4+的浓度为多少?已知0.5 mol/L H2SO4介质中,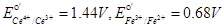 。(10分)
。(10分)
3称取纯KIOx试样0.7499g,将碘还原成碘化物后,用0.2000 mol/L AgNO3标准溶液滴定,用去15.24 mL。计算分子式中的x。(9分)
4今有纯CaO和BaO的混合物2.723 g,转化为混合硫酸盐后其质量为5.623 g,计原混合物中CaO和BaO的质量分数。(10分)
5酸碱滴定中,HCN:Ka=7.2×10-10,计算1.0×10-4 mol/LNaCN溶液的pH值。(20分)
6在25.0 mL 0.10mol.L-1的H3PO4中加入多少毫升0.10 mol.L-1NaOH溶液,即可得到pH=7.00的缓冲溶液?(已知H3PO4的PKa2=7.20)(20分)
7络合滴定中,0.20 mol/L溶液Al中,游离F–浓度为0.02 mol/L.(lgKAlY=16.3; F–引起的络合效应系数αAl(F)=8.9×109; pH=5.00,
lgαY(H)=6.45.)。在pH=5.00的溶液中,计算AlY的条件形成常数。(15分)
8以NH3–NH4+缓冲溶液控制锌溶液的pH=10.0,对于EDTA定Zn2+的主反应,(1)计算[NH3]=0.10 mol/L,[CN–]=1.0×10-3 mol/L时的αZn和lgK'ZnY。如果CY=CZn=0.02000
mol/L,求计量点时游离Zn2+的浓度[Zn2+]等于多少? pH=10.0时,lgβ1~lgβ4,分别为2.27,4.61,7.01,9.06;Zn-OH各累积稳定常数分别为:lgβ1`~lgβ4`:4.4;10.1;14.2;15.5;lgKZnY=16.50;pH=10.0,lgαY(H)=0.45(20分)
更多内容,请点击获取:
http://shuyue.100xuexi.com/Ebook/986446.html
