考研真题
1. 清华大学《837物理化学》历年考研真题汇总
2. 全国名校物理化学考研真题汇总(含部分答案)
考研指导书
1. 傅献彩《物理化学》(第5版)笔记和课后习题(含考研真题)详解
2. 傅献彩《物理化学》(第5版)(上册)配套题库【考研真题精选+章节题库】
3. 傅献彩《物理化学》(第5版)(下册)配套题库【考研真题精选+章节题库】

傅献彩《物理化学》(第5版)笔记和课后习题(含考研真题)详解
书籍目录
第1章 气 体
第2章 热力学第一定律
第3章 热力学第二定律
第4章 多组分系统热力学及其在溶液中的应用
第5章 相平衡
第6章 化学平衡
第7章 统计热力学基础
第8章 电解质溶液
第9章 可逆电池的电动势及其应用
第10章 电解与极化作用
第11章 化学动力学基础(一)
第12章 化学动力学基础(二)
第13章 表面物理化学
第14章 胶体分散系统和大分子溶液

部分内容
第1章 气 体
1.1 复习笔记
【通关提要】本章通过气体分子运动模型,从微观角度了解分子的运动规律。本章重点在于了解气体分子的性质,如运动公式、速率分布、能量分布、碰撞频率等。在非理想气体中重点了解van der Waals方程及对比状态定律。
【知识框架】

【重点难点归纳】
一、气体分子动理论
1理想气体
理想气体:符合方程pV=nRT。
【补充】气体在低压及较高温度下更符合状态方程pV=nRT
2气体分子动理论的基本公式
(1)气体的根均方速率

式中,u称为气体的根均方速率;
(3)气体压力和根均方速率的关系(根据气体分子动理论导出的基本方程式)
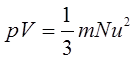
3几个经验定律(见表1-1-1)
表1-1-1 经验定律总结

二、理想气体的状态图
理想气体均表示曲面上且满足关系式: ,该状态图也称为相图。(见图1-1-1和1-1-2)
,该状态图也称为相图。(见图1-1-1和1-1-2)

图1-1-1 p-V坐标图上理想气体在不同温度下的等温线
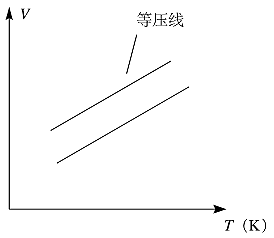
图1-1-2 V-T坐标图上理想气体在不同压力下的等压线
三、分子运动的速率分布
1Maxwell速率分布定律

分子速率分布曲线与温度的关系(见图1-1-3)

图1-1-3 分子速率分布曲线与温度的关系
【关系推导】T2>T1,随着温度升高,最高点下移。
2分子速率的三个统计平均值比较(见表1-1-2)
表1-1-2 分子速率的三个统计平均值比较

四、分子平动能的分布
1分子能量处于E~(E+dE)之间的分子占总分子中的分数
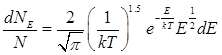
能量分布函数f(E)

2在二维平面能量大于某定值E1的分子分数

3在三维空间能量大于某定值E1的分子分数

五、气体分子在重力场中的分布
Boltzmann(玻耳兹曼)公式:



六、分子的碰撞频率和平均自由程
1平均自由程

2分子的互碰频率

3分子与器壁的碰撞频率

4分子隙流
隙流速度

七、实际气体
1实际气体的行为
(1)压缩因子(Z)衡量偏差的大小:

【判据】①理想气体的pVm=RT,Z=1。
②对实际气体,若Z>1,则pVm>RT,实际气体的可压缩性比理想气体小。
③当Z<1时,情况则相反。
(2)Z的变化类型
①Z随压力增加而增加,如H2。
②随压力增加而先下降再上升,有最低点,如CH4。
2Boyle温度

时的温度为Boyle温度。
【判据】当气体温度高于TB时,气体难以压缩,难以液化。
3van der Waals方程式

4维利方程

八、气液间的转变——实际气体的等温线和液化过程
1van der Waals方程式的等温线
范氏方程展开后,可得

Vm值可以有三种情况:(1)一实根两虚根;(2)三个相等的实根;(3)三个数值不同的实根。
2对比状态
定义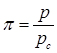 ,
, ,
, ,则van der Waals对比状态方程为
,则van der Waals对比状态方程为

九、压缩因子——实际气体的有关计算

获取方式:扫码关注下面公众号,关注后

回复关键词【清华大学837】或【清华大学物理化学】
